TEMA 15. CONTAMINACION POR METALES PESADOS
5 Factores del suelo que afectan su acumulación y disponibilidad
La toxicidad de un agente contaminante no sólo va
a depender de sí mismo sino que las características del suelo
donde se encuentre van a ser decisivas. La sensibilidad de los suelos a
la agresión de los agentes contaminantes va a ser muy distinto dependiendo
de una serie de características edáficas.
![]() pH.
pH.
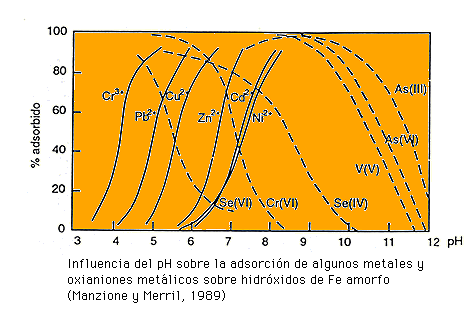
Es un factor esencial. La mayoría de los metales tienden a estar más disponibles a pH ácido, excepto As, Mo, Se y Cr, los cuales tienden a estar más disponibles a pH alcalino.
El pH, es un parámetro importante para definir la movilidad del catión, debido a que en medios de pH moderadamente alto se produce la precipitación como hidróxidos. En medios muy alcalinos, pueden nuevamente pasar a la solución como hidroxicomplejos.
Por otra parte, algunos metales pueden estar en la disolución del suelo como aniones solubles. Tal es el caso de los siguientes metales: Se, V, As, Cr.
La adsorción de los metales pesados está fuertemente condicionada por el pH del suelo (y por tanto, también sus solubilidad).
![]() Textura.
Textura.
La arcilla tiende a adsorber a los metales pesados, que quedan retenidos en sus posiciones de cambio. Por el contrario los suelos arenosos carecen de capacidad de fijación de los metales pesados, los cuales pasan rapidamente al subsuelo y pueden contaminar los niveles freáticos.
![]() Estructura.
Estructura.
Favorece la entrada e infiltración de la contaminación de metales pesados en el suelo.
![]() Mineralogía de las arcillas.
Mineralogía de las arcillas.
Cada especie mineral tiene unos determinados valores de superficie específica y descompensación eléctrica. Ambas características son las responsables del poder de adsorción de estos minerales. La capacidad de cambio de cationes es mínima para los minerales del grupo de la caolinita, baja para las micas, alta para las esmectitas y máxima para las vermiculitas.
![]() Materia Orgánica.
Materia Orgánica.
Reacciona con los metales formando complejos de cambio y quelatos. Los metales una vez que forman quelatos o complejos pueden migran con mayor facilidad a lo largo del perfil.
La materia orgánica puede adsorber tan fuertemente a algunos metales, como es el Cu, que pueden quedar en posición no disponible por las plantas. Por eso algunas plantas, de suelos orgánicos, presentan carencia de ciertos elementos como el Cu. El Pb y el Zn forman quelatos solubles muy estables.
La complejación por la materia orgánica del suelo es una de los procesos que gobiernan la solubilidad y la bioasimilidad de metales pesados. La toxicidad de los metales pesados se potencia en gran medida por su fuerte tendencia a formar complejos organometálicos, lo que facilita su solubilidad, disponibilidad y dispersión. La estabilidad de muchos de estos complejos frente a la degradación por los organismos del suelo es una causa muy importante de la persistencia de la toxicidad. Pero también la presencia de abundantes quelatos puede reducir la concentración de otros iones tóxicos en la solución del suelo.
La estabilidad de los complejos tiende a seguir la siguiente secuencia: Cu > Fe > Mn = Co > Zn
![]() Capacidad de cambio.
Capacidad de cambio.
Es función del contenido de arcilla y materia orgánica, fundamentalmente. En general cuanto mayor sea la capacidad de intercambio catiónico, mayor será la capacidad del suelo de fijar metales. El poder de adsorción de los distintos metales pesados depende de su valencia y del radio iónico hidratado; a mayor tamaño y menor valencia, menos fuertemente quedan retenidos.
![]() Condiciones redox.
Condiciones redox.
El potencial de oxidación-reducción es responsable de que el metal se encuentre en estado oxidado o reducido. Los diagramas Eh-pH se utilizan para mostrar la estabilidad de compuestos de metales pesados y proporciona un método fácil para predecir el comportamiento de los metales pesados frente a un de cambio en las condiciones ambientales.
i) Cambio directo en la valencia de ciertos metales; por ejemplo, en condiciones reductoras el Fe3+ se transforma en Fe2+, los iones reducidos son mucho más solubles.
ii) En segundo lugar, las condiciones redox pueden afectar indirectamente la movilidad de metales. Así muchos metales están asociados o adsorbidos a hidróxidos de Fe y Mn, estos no son estables a Eh bajos y se convierten en FeS o FeCO3 dependiendo de las condiciones químicas, cuando esto ocurre los metales que estaban asociados con los hidróxidos de Fe y Mn se movilizan.
En ambientes muy reductores el Fe se puede combinar con el S2- hasta convertirse en pirita. Cuando los suelos y sedimentos contienen cantidades significantes de pirita y aumenta el Eh (creación de condiciones mas oxidantes) el S2- se oxida a SO4= liberando cantidades de H2SO4, el suelo se acidifica fuertemente y los metales se hacen muy solubles.
Un interesante ejemplo ejemplo lo representa el diagrama Eh-pH para el Pb que reproducimos en la siguiente figura.
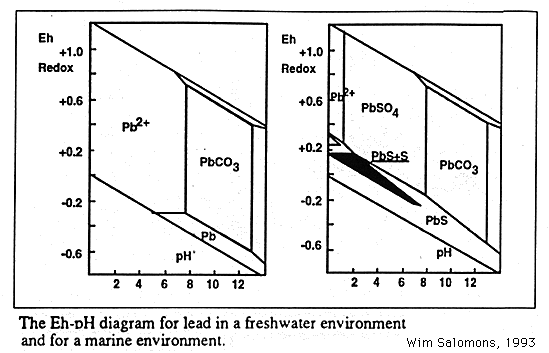
La fase estable dominante es PbCO3, que se hace más inestable si las condicciones ambientales son más ácidas. El PbCO3 tiene un elevado producto de solubilidad y cuando este mineral se encuentra en aguas superficiales, se observan altas concentraciones de Pb. Por otra parte, cuando el azufre es abundante se forman los compuestos indicados en el diagrama de la derecha. Bajo condiciones reductoras (bajo Eh) el PbS es la fase estable. El sulfuro de plomo se forma en estuarios y medios marinos donde los sulfatos se reducen a sulfuros que reaccionan con plomo para formar sulfuro de plomo (insoluble). Por tanto condiciones ambientales que provoquen un aumento del potencial redox, podrían originar la inestabilidad del sulfuro de plomo, con una subida de la concentración de plomo disuelto.
Muy ilustrativa es la tabla que Plant y Raiswell (1983) han desarrollado sobre la movilidad de los metales pesados y elementos asociados en función de las condiciones de pH y Eh.
Movilidad relativa de los metales pesados según el Eh y pH del suelo | ||||
| Movilidad | Oxidante | Acido | Neutro y alcalino | Reductor |
| Alta | Zn | Zn, Cu, Co, Ni, Hg, Ag, Au | ||
| Media | Cu, Co, Ni, Hg, Ag, Au, Cd | Cd | Cd | |
| Baja | Pb | Pb | Pb | |
| Muy baja | Fe, Mn, Al, Sn, Pt, Cr, Zr | Al, Sn, Pt, Cr | Al, Sn, Cr, Zn, Cu, Co, Ni, Hg, Ag, Au | Zn, Cu, Co, Ni, Hg, Ag, Au, Cd, Pb |
![]() Oxidos e hidróxidos de Fe y Mn.
Oxidos e hidróxidos de Fe y Mn.
Juegan un importante papel en la retención de los metales pesados. Tienen una alta capacidad de fijar a los metales pesados e inmovilizarlos. Además, estos compuestos se presentan finamente diseminados en la masa del suelo por lo que son muy activos. Los suelos con altos contenidos de Fe y Mn tienen una gran capacidad de adsorber metales divalentes, especialmente Cu, Pb y en menor extensión Zn, Co, Cr, Mo y Ni.
![]() Carbonatos.
Carbonatos.
La presencia de carbonatos garantiza el mantenimiento de altos valores de pH, en los que como ya hemos visto tienden a precipitar los metales pesados. El Cd, y otros metales, presenta una marcada tendencia a quedar adsorbido por los carbonatos.
![]() Salinidad.
Salinidad.
El aumento en salinidad puede incrementar la movilización de metales pesados por dos mecanismos. Primeramente los cationes asociados con las sales (Na, K) pueden reemplazar a metales pesados en lugares de adsorción. En segundo lugar los aniones cloruro pueden formar complejos solubles estables con metales pesados tales como Cd, Zn y Hg. Tienden a dar suelos de pH básicos.
En definitiva, según la forma en la que se encuentre el metal retenido en el suelo, así será la disponibilidad relativa por las plantas y por tanto la incorporación en los organismos.
| Forma de retención en el suelo | Disponibilidad relativa |
| Iones en solución del suelo | Fácilmente disponible |
| Ión en complejo de cambio | Relativamente disponibles pues estos metales, por su pequeño tamaño y altas cargas, quedan fuertemente adsorbidos |
| Metales quelados por compuestos orgánicos | Menos disponibles |
| Metal precipitado o coprecipitado | Disponible sólo si ocurre alguna alteración química |
| Incorporado a la matriz biológica | Disponible después de la descomposición |
| Metal en la estructura mineral | Disponible después de la meteorización |
Al ir transcurriendo el tiempo disminuye la disponibilidad de los metales, ya que se van fijando en las posiciones de adsorción más fuertes y también los geles van envejeciendo y se van volviendo más cristalinos.
En general se considera que la movilidad de los metales pesados es muy baja, quedando acumulados en los primeros centímetros del suelo, siendo lixiviados a los horizontes subsuperficiales en muy pequeñas cantidades. Es por ello que la presencia de altas concentraciones en el horizonte superficial seguida de un drástico decrecimiento a los pocos centímetros de profundidad es un buen criterio de diagnóstico de contaminación antrópica.
Programa | Lección 15 | Anterior | Siguiente | Principio página