|
|
|
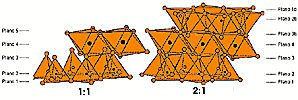
 Estructuras
1:1 y 2:1. Si la estructura termina en el plano 5, todos
los vértices están ocupados por OH y se trataría
de una estructura de lámina 1:1 (formada por un tetraedro
y un octaedro), pero si la estructura continua los iones de este
plano son O y OH. En este caso este plano 5 sería igual
al plano 3 (representado en el dibujo como 3b). Luego vendrán
los planos 2b y 1b. Es como si el plano 4 fuese un plano de simetría
que refleja a los planos 1, 2 y 3 a cada lado. Se forma la lámina
2:1 (dos capas de tetraedros que encierran a una de tetraedros).
La lámina 1:1 tiene un espesor de 7 amstrong mientras
que para la 2:1 el espesor es de 9. Estructuras
1:1 y 2:1. Si la estructura termina en el plano 5, todos
los vértices están ocupados por OH y se trataría
de una estructura de lámina 1:1 (formada por un tetraedro
y un octaedro), pero si la estructura continua los iones de este
plano son O y OH. En este caso este plano 5 sería igual
al plano 3 (representado en el dibujo como 3b). Luego vendrán
los planos 2b y 1b. Es como si el plano 4 fuese un plano de simetría
que refleja a los planos 1, 2 y 3 a cada lado. Se forma la lámina
2:1 (dos capas de tetraedros que encierran a una de tetraedros).
La lámina 1:1 tiene un espesor de 7 amstrong mientras
que para la 2:1 el espesor es de 9. |
|
 |
|
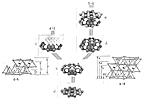
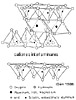
Los minerales del grupo de los filosilicatos se originan
por simple apilamiento de láminas 1:1 ó 2:1. Como
la capa octaédrica puede ser de Mg o de Al, básicamente
se dan sólo cuatro combinaciones:
1:1 triocta ---> Serpentina
1:1 diocta ---> Caolinita
2:1 triocta ---> Talco
2:1 diocta ---> Pirofilita
|
|
 |
|
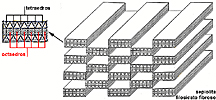
Una variante aparece cuando los tetraedros,
cada cierto número, se invierten. Los planos se interrumpen
en esta zonas de tetraedros y octaedros girados 180°, apareciendo
una estructura en listones, por lo que a estos filosilicatos
se le llama fibrosos, en vez de laminares como corresponde al
resto de las otras estructuras. Si el giro es cada 4 tetraedros
el mineral es paligorskita (también llamado atapulgita)
y si es cada seis se trata de sepiolita. |
|
 |
|
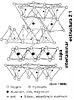
Pero en la Naturaleza se presentan un
número muy numeroso de minerales dentro del grupo de los
filosilicatos. Esto es debido a las sustituciones isomórficas
entre los cationes octaédricos y tetraédricos.
Además estas sustituciones suelen ser entre cationes de
distinta valencia lo que origina desequilibrios eléctricos
en la red y para compensarse entran otros iones, que al no tener
sitio en los nudos de la red, se sitúan entre las láminas
1:1 y mucho más frecuentemente entre las 2:1. Estos iones
interlaminares pueden entrar hidratados en diverso grado, separando
las capas, con lo que el espesor del paquete es variable, normalmente
oscila entre 10 y 18 amstrong. La sustitución normal en
la capa tetraédrica es la del Si por el Al (el Al es un
catión de coordinación octaédrica, pero,
por su tamaño, frecuentemente se introduce en las capas
tetraédricas produciendo una pequeña deformación
en los tetraedros; esto no ocurre nunca con el Mg, de mayor tamaño),
La sustitución de cada Si++++ por un Al+++ necesita de
la incorporación de un catión interlaminar monovalente,
o si es un divalente lo hace por cada dos sustituciones Si por
Al; este es el caso de las micas, en las que entra el K+ como
catión interlaminar (espesor de 10 amstrong, fijo). En
las capas octaédricas es frecuente la sustitución
entre el Al y el Mg; éste es el caso de la serie de las
esmectitas, cuyo mineral más representativo es la montmorillonita
(espesor de 14 amstrong, variable). |
|
 |
|
Existe la posibilidad de que los cationes
interlaminares que entren a compensar los déficits de
carga sean a su vez cationes de coordinación octaédrica;
se origina así una nueva capa de octaedros en el espacio
interlaminar y se le llama estructura de tipo 2:1+1 (el 2 representa
a las dos capas de tetraedros y el 1+1 indica que las dos capas
de octaedros no son iguales, ya que la capa octaédrica
de la estructura 2:1 tiene la mayoría de los vértices
compartidos con las capas de tetraedros vecinos, mientras que
los octaedros del espacio interlaminar no comparten ningún
vértice con los tetraedros. El mineral típico es
la clorita. |





